1.介绍
在世界范围内,中风被列为仅次于缺血性心脏病的第二大常见死因,每年约有1700万新发病例和600万死亡病例[1]。它分别是美国女性和男性的第三和第五位主要死因[2]。多项证据表明,近几十年来,中风的患病率有所上升,尤其是在发展中国家。到2030年,预计将有340万美国人患中风,估计比2012年增加20.5%[2]。中风的特征是身体一侧麻木或虚弱,神志不清,或说话困难,或理解他人困难,或头晕。它大大降低了患者的生活质量,并造成巨大的公共卫生负担。一般来说,中风可分为两种主要类型,即缺血性中风(IS)和出血性中风。IS是目前中风的主要类型,占所有中风病的87%[2]。大约有一半的中风患者死于IS[3]。
近年来,越来越多的证据强调IS的发病率存在性别差异。在大多数年龄组,男性的IS发病率高于女性。有报道表明,IS的预后也存在性别差异。例如,Rutten-Jacobs等人[4]发现,IS后20年的男性死亡率高于女性。此外,男性和女性之间的症状也不同。女性经常表现为非传统的中风症状,如精神状态改变、瘫痪、意识水平下降、全身麻木或虚弱,而男性则更经常表现为感觉丧失、发音困难、复视、共济失调和行走问题[5]。美国国立卫生研究院(National Institute of Health,NIH)已经认识到,了解两性之间的生物学差异对于开发有效的疗法至关重要[6]。人们已经做了很大的努力去阐明IS的病理生理机制,但至今仍不清楚IS存在性别差异的机制。
基于高通量平台进行全基因组表达谱分析的微阵列是一种有前途和有效的工具,可用于识别调节患缺血性中风的基因组变异。为了确定性别差异的关键基因,我们进行了一项基于基因表达微阵列数据集的综合生物信息学分析。这项研究为性别特异性机制的研究提供了切入点,并可能为疾病治疗提供潜在的治疗靶点。
2.材料和方法
2.1微阵列数据
本研究的基因表达数据来自高通量基因表达数据库(gene expression omnibus,GEO)(https://www.ncbi.nlm.nih.gov/geo/)检索号为GSE22255[7]。数据集基于GPL570[HG-U133+2]Affymetrix人类基因组U133 + 2.0系列(Affymetrix,Santa Clara,USA)平台。本研究共纳入40份血清样本,其中男性IS患者10份,女性IS患者10份,健康对照组20份。根据本研究的目的,选取20个IS样本进行进一步分析。所有IS患者均为成年白种人,平均年龄60.2±10.6岁。要求所有人在采血前至少6个月内只发作过1次中风。
2.2差异性表达分析
采用R软件和相关的R包对差异表达基因(DEGs)进行归一化和分析。首先,利用R软件中的log2变换对数据集进行归一化。然后,用线性模型对R中微阵列数据(limma)包进行IS女性和男性之间的DEGs筛选。选取显著基因,阈值为|log2 fold change (FC)|≥1.58,调整后P值<0.05。
2.3功能富集分析
为了进一步分析IS女性与IS男性DEGs的生物学过程,通过数据库对DEGs进行功能富集分析,并进行注释、可视化和综合发现(DAVID version 6.8, https://david.ncifcrf.gov/)[8]。以基因本体论(gene ontology,GO)术语和基因和基因组百科全书(Kyo to Encyclopedia of Genes and Genomes,KEGG)通路为富集值,富集基因计数>2,阈值P <0.05。
2.4 PPI网络分析
用于检索相互作用基因的搜索工具(STRING, version 10.5, https://www.string-db.org/)[9]是一个著名的在线数据库和web工具,用于预测DEGs产品之间的相互作用。本研究通过字符串构建PPI网络,默认阈值为> 0.4,然后用Cytoscape(version 3.6.1)[10]可视化PPI网络。此外,节点代表生物分子,边缘连接着它们之间关系的节点[11]。根据它们的连通性确定PPI网络中的枢轴节点。
3.结果
3.1 DEGs的鉴别
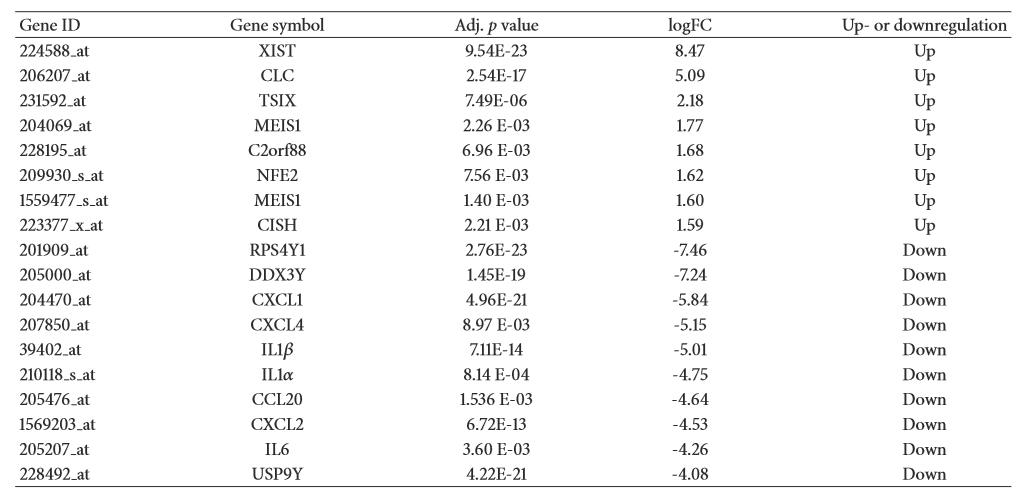
根据截断标准(|log2FC|≥1.58,调整后p值< 0.05),IS女性与IS男性血清样本共鉴定出123个DEGs,其中上调基因8个,下调基因115个。使用层次聚类方法对DEGs列表进行可视化,生成热图,可以清晰区分IS女性样本和IS男性样本(图1)。前8位上调基因和前10位下调基因如表1所示。
表1 缺血性中风女性和男性的8个上调和10个下调基因的表达差异
3.2 GO富集分析
进行GO富集分析,进一步了解与IS相关的所选DEGs的生物学过程。如图2所示,DEGs共显著富集了33个GO项目,主要包括炎症反应(p=5.47E-11, 包括CXCL1、CXCL2、IL1?、IL6、CCL4和PTGS2),信号转导(p=3.58E-04,包括CXCL1和IL1?),积极调节平滑肌细胞增殖(p=2.10E-07,包括IL6 和PTGS2),免疫应答(p=1.18E-05,包括CXCL1、CXCL2、CXCL20、IL1?、IL1 ?、IL6和CCL4)和凋亡过程(p=6.85E-04,主要包括IL6和IL1?)。
3.3 KEGG通路分析
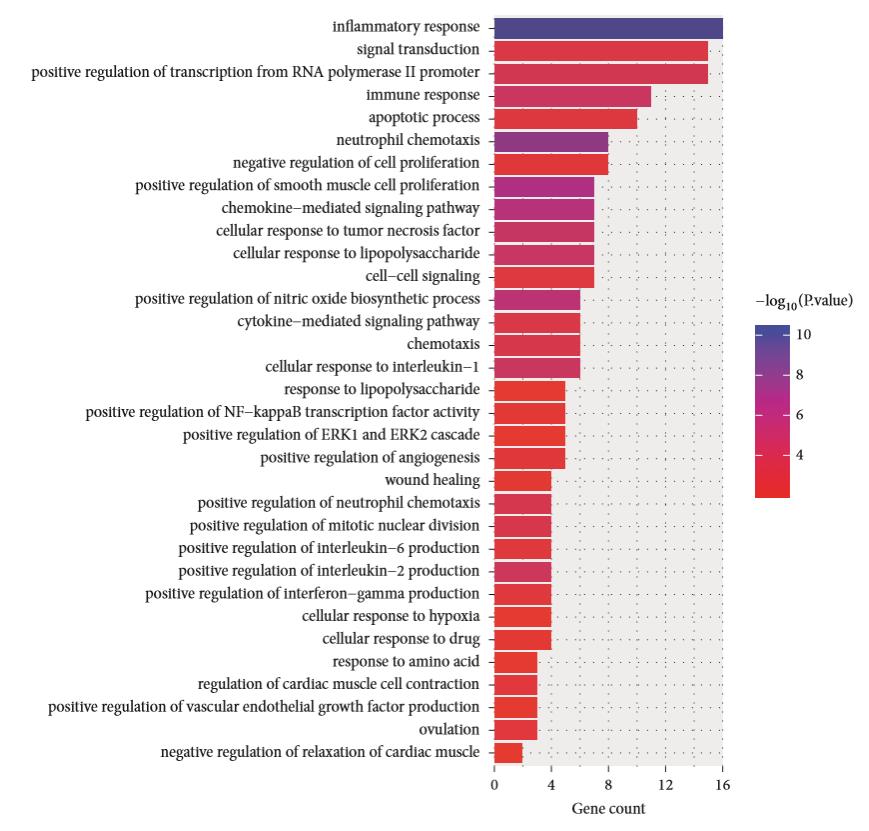
KEGG通路分析被用于对本研究筛选的DEGs通路进行更深入的了解。如图3所示,共有17个通路主要富集在肿瘤坏死因子信号通路(p=7.77E-09,包括 CXCL1、CXCL2、CXCL20、IL1?、IL6、ICAM1和PTGS2),NOD-样受体信号通路(p=2.92E-04,包括IL1?和IL6),趋化因子信号通路(p=4.57E-03,包括CXCL1、CXCL2、CXCL20和CCL4)。
图1 缺血性中风男性和女性的基因表达值
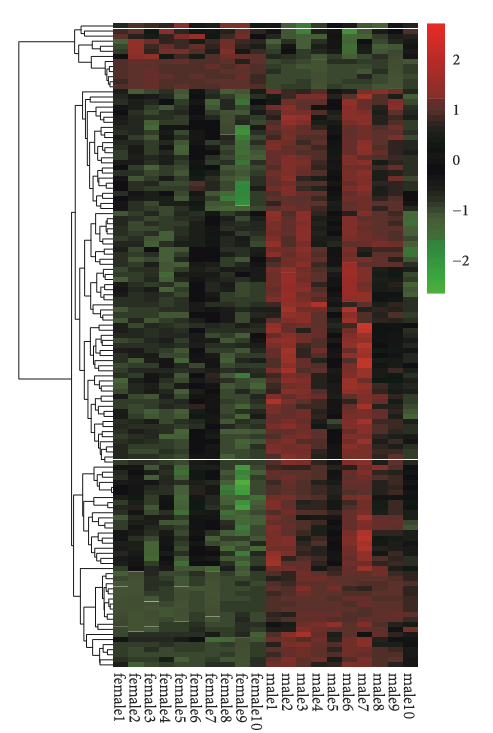
图2 缺血性脑卒中女性和男性DEGs的GO富集分析
 3.4 PPI网络建设
3.4 PPI网络建设
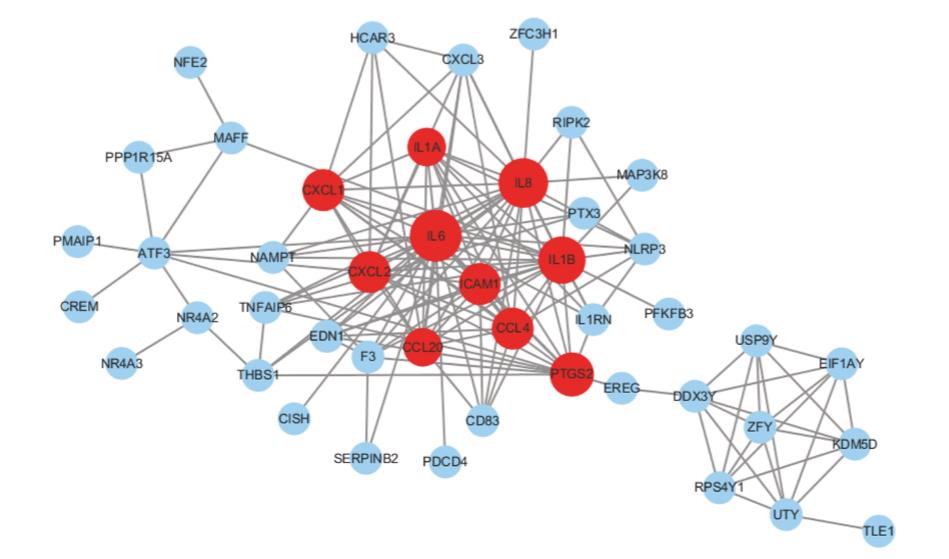
为了更好地理解DEGs的交互作用,利用字符串数据库进行了PPI网络构建。如图4所示,中心基因节点度大于或等于10的是IL1?、IL1 ?、IL6、IL8、CXCL1、CXCL2、CXCL20、ICAM1、CCL4和PTGS2。有趣的是,来自IS女性的血清样本中,所有的hub基因都被下调。在这些基因中,IL6、IL8和IL1?显示了最高节点度,分别是23、22和21。
图3 缺血性中风女性和男性DEGs富集通路KEGG分析
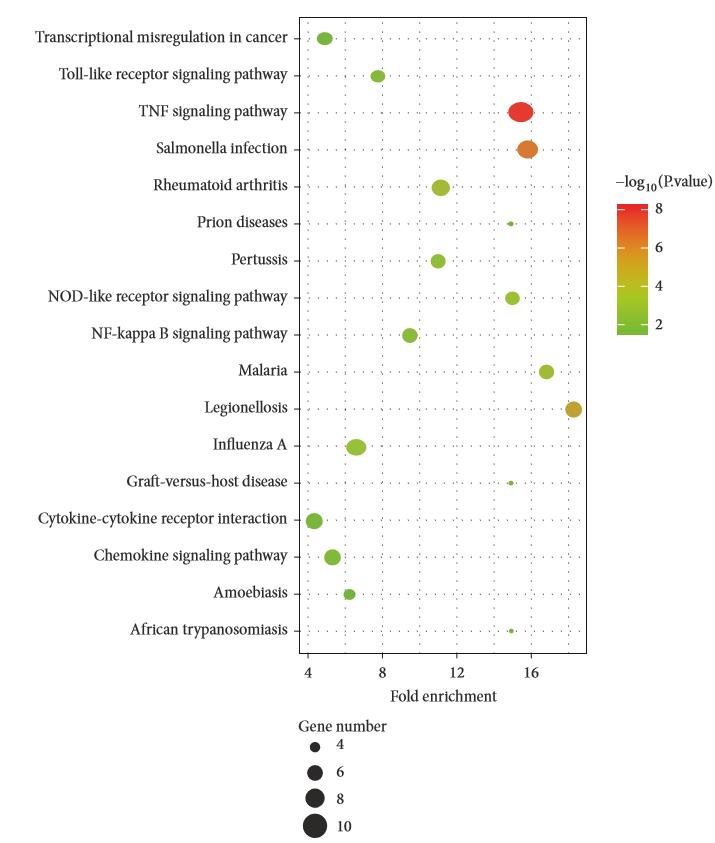
图4 缺血性中风PPI网络的性别差异。红色代表hub基因节点度³10。
4.讨论
IS是一种复杂的神经系统疾病,具有很高的发病率和死亡率。在病因、危险因素和预后方面存在性别差异。性激素(雌激素和雄激素),性染色体(XX和XY),社会和环境因素都有助于解释这些性别差异,虽然只是部分原因。在过去的十年里,包括IS在内的许多疾病的遗传学都取得了重大突破。在动物模型中对IS进行了大量的性别间遗传分析。不幸的是,很少有人类IS的性别之间差异的微阵列分析[12]。首先,通过比较IS患者和健康对照者的血液,研究了性别对全基因组微阵列RNA表达的影响。最近,几项研究在人类血液中发现了IS病例和对照组之间的关键基因[7,13-15]。然而,人们对性别差异背后的确切机制仍知之甚少。
在本研究中,我们的目的是用全基因组微阵列来确定IS患者女性血清和男性血清中基因表达的性别差异。在性别间共鉴定出123个DEGs,包括8个上调基因和115个下调基因。在PPI网络中,发现了10个关键基因包括IL1?、IL1?、IL6、IL8、CXCL1、CXCL2、CXCL20、CCL4、ICAM1和PTGS2。有趣的是,所有这些基因在IS女性中被下调,而在IS男性中被上调。IL1?、IL1 ?、IL6和IL8都是白介素家族的成员。IL1?和IL1? 属于IL1细胞因子家族,介导炎症过程,参与各种免疫反应、炎症过程[16]。一项最近的研究报道,IS患者血清和龈沟液中IL1、IL6和TNF-?高于健康者[17]。根据我们的网络构建结果,IL6和IL8似乎比其他基因更重要。IL6是一种多效细胞因子,在急性炎症反应中起重要作用[18]。既往研究表明,血清和脑脊液IL6水平升高与脑卒中预后不良有关。同样,最近的一项研究报道了血清IL8水平升高与IS后严重残疾之间的正相关。CXCL1和CXCL2是导致中性粒细胞外渗的主要趋化因子。CXCL1,也被称为生长相关癌基因,据报道,在脑卒中患者的脑脊液中,早期阶段立即升高[21]。PTGS2又称环氧化酶2(COX2),是前列腺素生物合成的关键酶[22]。对4,086例IS病例和4,747例对照的荟萃分析表明,PTGS2的G765C等位基因变异可能导致IS的发病率升高,特别是在巴西人和非洲裔美国人的中更明显[23]。综上所述,男性IS高发病率和预后差的一个可能解释是这些上调的关键基因的作用。
基因表达的改变可以影响IS中许多生物学功能中的蛋白质和通路。我们发现这些基因主要富集于免疫应答和凋亡的生物学过程,以及TNF-?和NOD样受体信号通路。越来越多的研究表明,免疫应答与脑缺血的表现和进化有关[24]。肿瘤坏死因子属于肿瘤坏死因子家族,包括TNF-?和TNF-?。先前的研究已经提供了很多证据,TNF-?诱发IL-1、IL-6的表达、细胞坏死或凋亡。高血清TNF -?水平与中风后预后差有关[25]。NOD-样受体是一类胞质蛋白家族,参与细胞内病原体的识别[26]。NOD样受体蛋白3炎性小体是目前研究最多的一种多蛋白。它作为免疫反应的关键介质,参与了脑卒中后的神经血管单位损伤。此外,白介素抑制剂, IL-1、IL-6、TNF-?抑制剂已被认为是有前途的治疗免疫和炎症相关疾病的方法。根据我们的研究结果,我们强烈建议在预防和治疗IS时可以选择性地考虑免疫疗法。进一步的生物学研究仍然需要证实我们的发现。
综上所述,我们所鉴定的10个基因可能通过直接或间接参与免疫应答和凋亡的生物学过程,以及TNF和NOD样受体信号通路,对IS女性具有保护作用。这项研究的结果可能有助于对IS潜在的性别特异性机制有新的认识,并可能为疾病治疗提供潜在的治疗靶点。
致谢
本研究受国家自然科学基金课题资助(No.81273701),山东省中医药科技发展计划项目(No.2015-391);淄博市科学技术发展计划项目(No. 2015kj010136;2017kj010074)。
参考文献(略)


